- 最新进展
- 产品信息
一、ALK4与ActRIIB:TGF-β超家族信号通路中的核心受体对
ALK4与ActRIIB是转化生长因子-β(TGF-β)超家族信号通路中一对功能耦合的I型与II型跨膜丝氨酸/苏氨酸激酶受体。ActRIIB作为II型受体,其胞外区可高亲和力结合活化素(Activin)、GDF8(肌抑素)、GDF11等多种配体,并具有组成性激酶活性。与之对应,ALK4作为I型受体,其激活严格依赖于II型受体的调控,二者在配体存在下形成稳定的异源四聚体信号转导复合物。
在该复合物中,配体首先与ActRIIB结合,进而招募并磷酸化ALK4胞内区高度保守的GS结构域,解除其自抑制状态。活化的ALK4进而特异性磷酸化下游信号介质SMAD2/3,引导其与SMAD4形成转录复合物并转位入核,调控靶基因表达。这一信号轴在胚胎发育、肌肉代谢稳态、红细胞生成及纤维化进程中发挥核心调控作用。
鉴于ALK4:ActRIIB受体对介导了GDF8等关键因子的肌肉生长抑制信号,该通路已成为治疗肌肉萎缩性疾病、代谢综合征及纤维化疾病的明星靶点。针对该系统的拮抗策略,包括可溶性受体陷阱和中和抗体,已在临床前及临床研究中展现出显著的治疗潜力。

阿塞勒隆制药公司申请了关于ALK4:ACTRIIB异多聚体和其用途的专利,该专利提供了可溶性异聚多肽复合物,其包含ALK4受体的细胞外结构域和ActRIIB的细胞外结构域。在某些方面,这样的可溶性ALK4:ActRIIB复合物可用于调节(促进或抑制)组织或细胞的生长,包括例如,肌肉、骨、软骨、脂肪、神经组织、肿瘤和/或癌细胞。在某些方面,这样的ALK4:ActRIIB复合物可用于改进肌肉形成、骨形成、代谢参数和与这些组织、细胞网络、肾和内分泌系统有关的病症。
二、ALK4:ACTRIIB异多聚体和其用途创新点概述
专利(CN107709357A)的核心创新在于开发了一种新型的可溶性异多聚体复合物,该复合物由ALK4(活化素受体样激酶4)的细胞外结构域与ActRIIB(活化素II型受体B)的细胞外结构域组成。与传统的同源二聚体(如ActRIIB-Fc同二聚体)相比,ALK4:ActRIIB异多聚体表现出独特的配体结合选择性:
- 增强的结合能力:对活化素A、活化素B、GDF8和GDF11等配体具有高亲和力;
- 显著减弱的结合能力:对BMP9、BMP10和GDF3的结合能力显著降低,尤其是对BMP9几乎不结合;
- 选择性信号抑制:在细胞模型中,该异多聚体能够有效抑制活化素A/B、GDF8和GDF11的信号传导,而对BMP9/BMP10的信号抑制能力大幅减弱。
这种配体选择性的转变使得ALK4:ActRIIB异多聚体成为一种更具靶向性的拮抗剂,适用于需要精准调控特定TGF-β超家族通路而不影响其他通路(如BMP9介导的血管生成)的疾病治疗场景。
三、ALK4:ACTRIIB异多聚体和其用途靶点筛选与表型筛选方法
1.靶点筛选策略
专利在靶点筛选方面采用了结构生物学与功能域分析相结合的方法:
结构域截断与功能验证:
通过对ALK4和ActRIIB的细胞外结构域进行系统截断(如ALK4的34–101位氨基酸、ActRIIB的29–109位氨基酸),确定了维持配体结合能力的核心区域;
利用半胱氨酸结结构(cysteine-knot motif)界定配体结合口袋,并通过突变分析验证关键残基(如ActRIIB中的L79不宜为酸性氨基酸)。
配体结合谱分析:
使用表面等离子共振(SPR)等技术系统评估了异多聚体与多种TGF-β配体(包括活化素、GDFs、BMPs)的结合动力学;
发现异多聚体对活化素B的亲和力强于同源二聚体,而对BMP9几乎无结合。
2.表型筛选方法
专利中采用了多层次表型筛选策略,包括:
细胞水平筛选:
使用SMAD报告基因系统(如A-204细胞系)评估异多聚体对下游信号通路(Smad2/3、Smad1/5/8)的抑制效果;
验证其在细胞模型中特异性抑制活化素A/B、GDF8、GDF11信号传导的能力。
动物模型验证:
在小鼠模型中评估异多聚体对肌肉、骨、脂肪组织代谢的影响;
在单侧输尿管梗阻(UUO)模型中验证其对肾纤维化、炎症和损伤的改善作用;
结果表明,异多聚体在促进肌肉生长、抑制脂肪积累、改善肾功能方面具有与ActRIIB同二聚体相当的效力,但避免了BMP9/BMP10通路抑制可能带来的血管生成副作用。
四、PROTAC与小分子治疗策略的拓展分析
尽管该专利主要聚焦于蛋白类异多聚体,但其揭示的ALK4:ActRIIB靶点机制为开发PROTAC与小分子治疗策略提供了重要基础:
PROTAC策略:
基于ALK4:ActRIIB复合物的结构信息,可设计双功能PROTAC分子,一端结合ALK4或ActRIIB,另一端招募E3泛素连接酶,诱导靶蛋白降解;
这种策略可用于增强靶向选择性,尤其是在需要彻底清除受体复合物的病理场景(如纤维化或肿瘤);
例如,针对ALK4:ActRIIB信号异常激活的疾病,PROTAC可实现对通路的长效抑制,避免传统拮抗剂的耐药性问题。
小分子抑制剂策略:
通过高通量筛选或结构导向设计,开发能够特异性结合ALK4或ActRIIB胞外域的小分子拮抗剂;
小分子可靶向配体-受体相互作用界面,阻断活化素、GDF8/11等配体的结合;
优势在于口服生物利用度高、生产成本低,适用于慢性疾病(如肌肉萎缩、肥胖、糖尿病)的长期治疗;
结合该专利中揭示的配体选择性机制,小分子设计可优先针对异聚体界面,实现更精准的通路调控。
五、总结与展望
该专利通过构建ALK4:ActRIIB异多聚体,成功实现了一种高选择性、多功能的TGF-β超家族信号调节工具。其在靶点筛选上结合了结构生物学与功能验证,在表型筛选上涵盖了细胞与动物多层次模型,为治疗肌肉萎缩、肥胖、纤维化、肾病等疾病提供了新思路。
未来,基于该靶点的PROTAC与小分子开发有望进一步拓展其治疗潜力,尤其是在需要高选择性、长效作用的复杂疾病中。同时,该异多聚体平台也可与抗体、融合蛋白等生物制剂结合,构建更复杂的多特异性药物系统,实现更精准的疾病调控。
如何解决ActRIIB与ActRIIA酶活性抑制剂筛选试剂盒难题?
优爱生物基于其在TGF-β信号通路研究领域的深厚积累,精准推出了与CN107709357A专利核心靶点高度协同的系列研究工具。
该专利揭示了ALK4:ActRIIB异二聚体作为选择性配体陷阱的独特优势,其效力依赖于对ActRIIB和ALK4受体活性的精确调控。为此,优爱生物开发的ActRIIB与ActRIIA酶活性抑制剂筛选试剂盒,为科研人员提供了功能验证的关键工具,能够高效筛选和评估特异性靶向II型受体的候选化合物。同时,南京优爱其提供的高纯度ALK4靶点蛋白,则为研究I型受体的结构生物学、结合动力学及开发新型ALK4靶向药物奠定了坚实的物质基础。这一系列产品线与专利揭示的机制紧密结合,共同构成了一个从靶点验证到抑制剂发现的完整研究解决方案,将显著推动针对肌肉萎缩、纤维化及代谢性疾病的新型疗法开发进程。
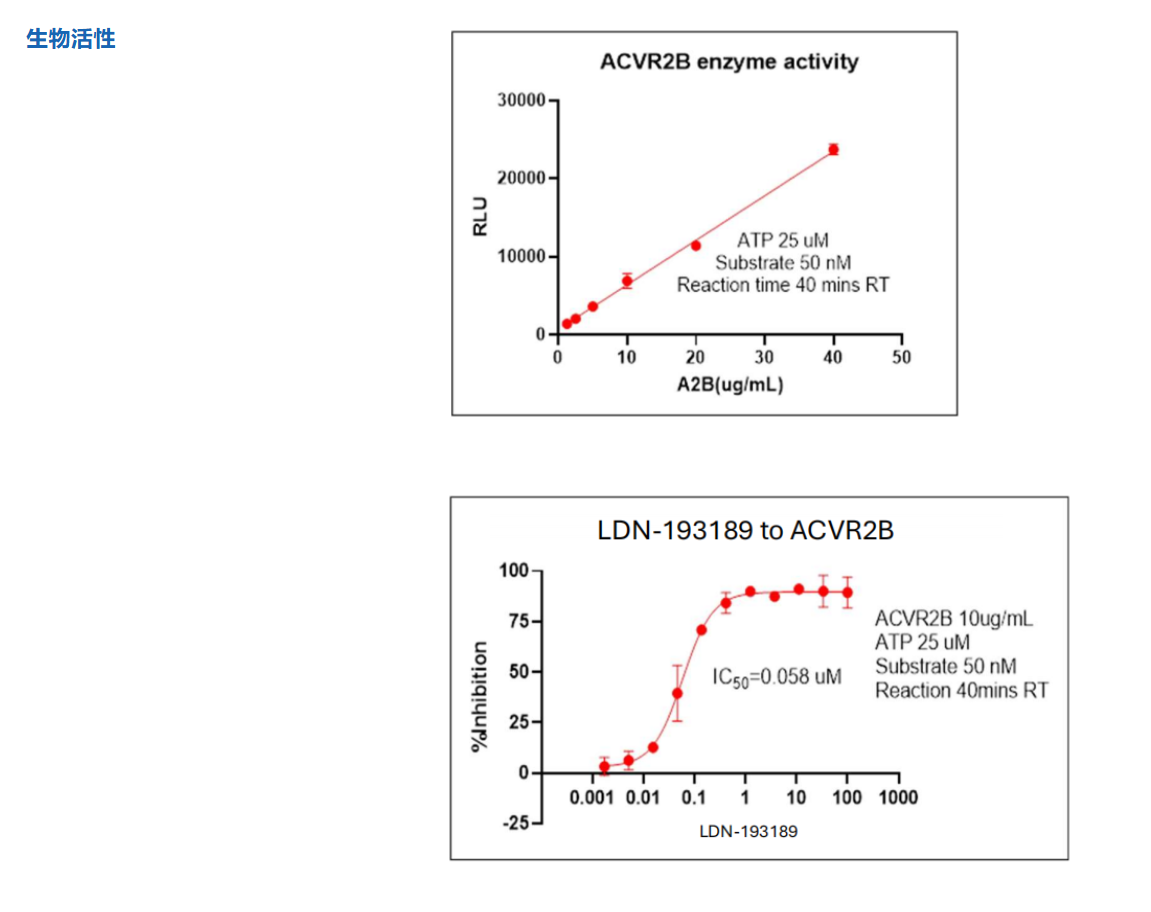
ActRIIB Enzyme Activity Inhibitor Screening Kit_UA080464_优爱(UA BIOSCIENCE)官网
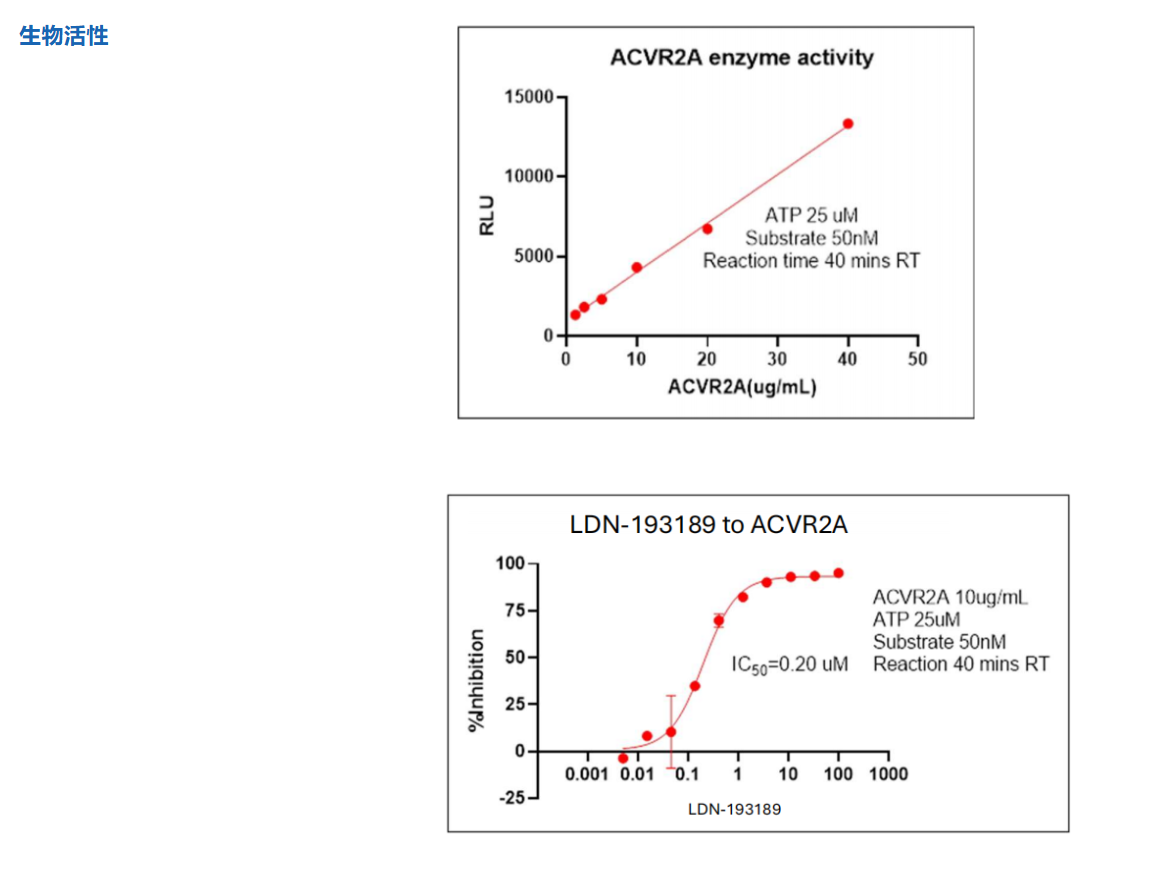
ActRIIA 酶活性抑制剂筛选 Kit_UA080465_优爱(UA BIOSCIENCE)官网
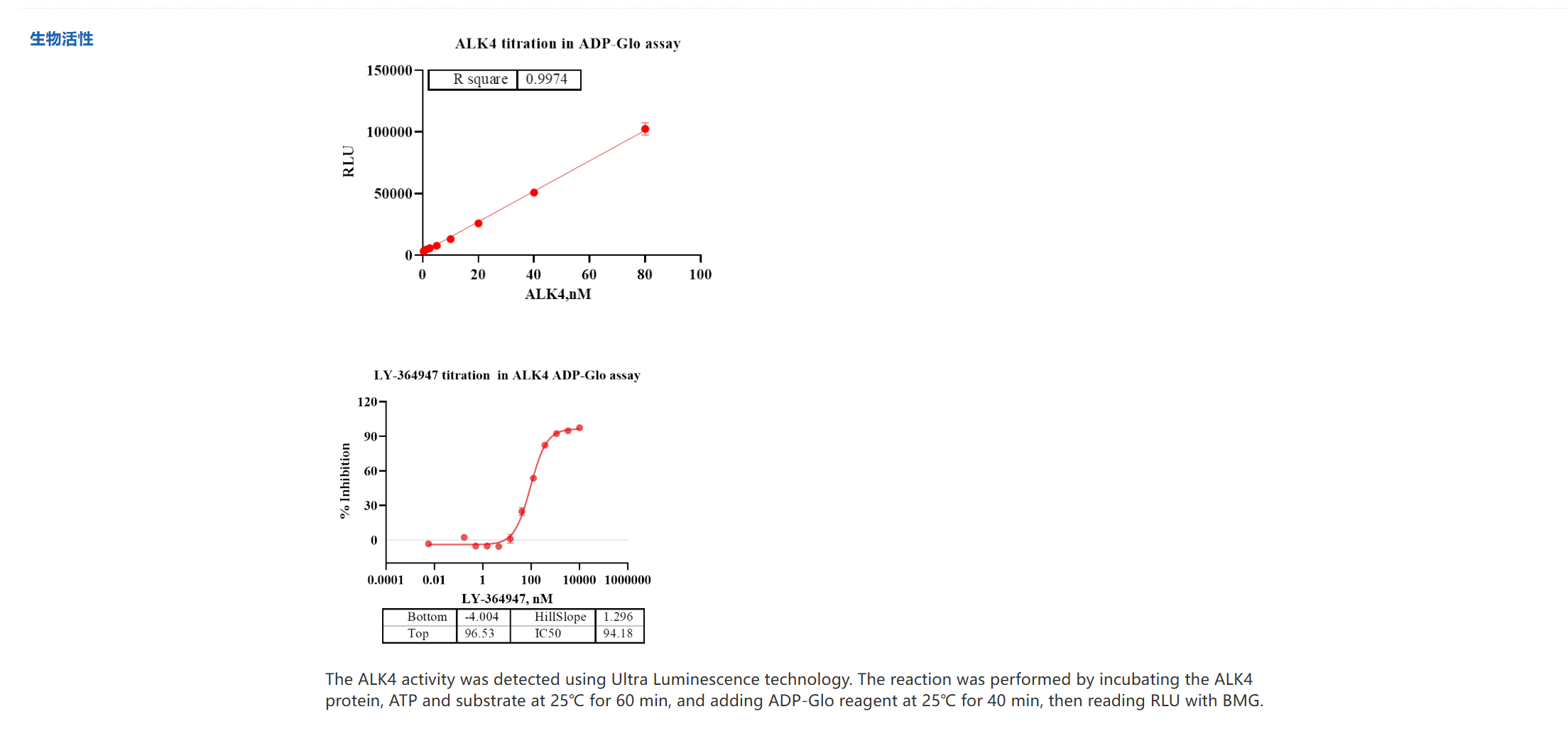
ALK4 Protein_UA080038_优爱(UA BIOSCIENCE)官网












