- 最新进展
- 产品信息
白介素-33(IL-33)---“警报素”细胞因子
白介素-33(IL-33)是一种关键的“警报素”细胞因子,在免疫防御和组织稳态中扮演着核心角色。
与其他细胞因子不同,IL-33在健康状态下预先合成并储存在屏障组织(如上皮细胞、内皮细胞)的细胞核内。当组织发生损伤或感染时,细胞坏死将其迅速释放,作为危险信号警报免疫系统。
其活性受氧化还原状态精密调控:还原形式(redIL-33)是具有生物活性的形态,能与细胞表面的ST2/IL-1RAcP受体结合,从而强力激活2型免疫反应,驱动Th2细胞、ILC2s等产生IL-5、IL-13,导致嗜酸性粒细胞炎症、黏液分泌等特征。而氧化形式(IL-33-DSB)则失去此活性,可能转而参与组织修复过程。
由于其在启动炎症中的核心作用,IL-33被视为哮喘、特应性皮炎、慢性阻塞性肺病(COPD) 等过敏性与炎症性疾病的关键驱动因子,也因此成为极具潜力的治疗靶标,针对它的中和抗体药物正在积极研发中。

免疫医疗有限公司申请了关于新颖的IL33形式、IL33的突变形式、抗体、测定及其使用方法的发明,该发明提供了经分离的IL 33蛋白、其活性片段;以及针对IL33蛋白的抗体、其抗原结合片段。例如出于治疗免疫和炎性障碍的目的,还提供了调节细胞因子活性的方法。
层面一:基础科学发现——IL-33的双重构象与功能悖论
专利首次明确提出了IL-33的两种稳定形式:
还原型IL-33(redIL-33):
功能:这是具有生物活性的形式,能够与其经典受体ST2结合,激活下游信号通路(如NF-κB),驱动Th2型免疫反应,导致IL-4、IL-5、IL-13等细胞因子的释放。
特性:其半胱氨酸残基(Cys208, Cys227, Cys232, Cys259)处于游离的还原状态。
氧化型IL-33(IL-33-DSB):
功能:这是失活形式,无法与ST2结合,因此不能启动经典的促炎信号。
新功能发现:专利首次揭示,这种氧化形式可以结合另一个受体——RAGE,可能介导了与组织修复、上皮迁移相关的非经典信号通路。
特性:通过上述半胱氨酸之间形成二硫键而稳定。
创新性体现:
颠覆认知:传统上IL-33被视为一个均一的促炎因子。该发现表明其存在一个“活性开关”(氧化还原状态),体内通过将redIL-33氧化为IL-33-DSB来自然终止炎症信号。
解释疾病机制:为理解炎症的启动与消退提供了新视角。
重新定义检测标准:指出当时商业化的检测方法主要识别的是大量存在的氧化形式,无法准确反映具有生物活性的还原形式,这为开发新的诊断方法指明了方向。
层面二:技术工具创新——稳定化突变体与新型抗体
传统的靶点筛选使用野生型蛋白,但野生型IL-33会迅速氧化,无法稳定呈现redIL-33构象。本专利的创新之处在于:
创造稳定的“锁定”靶点:通过半胱氨酸定点突变(如Cys→Ser)或定点生物素化,制备了一系列经工程化改造的IL-33突变体。这些突变体被“锁定”在还原的、活性的redIL-33构象,无法形成氧化的IL-33-DSB。
作为特异性“诱饵”:这些稳定的redIL-33突变体被用作免疫原(用于动物免疫)或筛选工具(用于噬菌体展示库等体外筛选)。这确保了筛选出的抗体是从一开始就针对具有生物活性的IL-33形式,而非大量存在的、无ST2结合能力的氧化形式。
为了从结合分子中筛选出真正的功能抑制剂,专利采用了多层次的功能性表型筛选:
第一重:阻断相互作用:使用表面等离子共振(SPR)或ELISA等生物物理技术,验证候选抗体是否能有效阻断redIL-33与其受体ST2的结合。这是最直接的机制验证。
第二重:抑制细胞信号传导:在表达ST2/IL-1RAcP受体的细胞系(如HEK-293工程细胞)中,测试抗体是否能抑制IL-33诱导的NF-κB报告基因激活或MAPK信号通路的激活。这验证了抗体在细胞水平的功能。
第三重:抑制功能性细胞因子释放:在更接近生理环境的原代人类肥大细胞或内皮细胞中,评估抗体对IL-33驱动的IL-5、IL-6、IL-8、IL-13等关键炎性细胞因子释放的抑制能力。这是最关键的药效学表型验证,确保抗体在复杂生物学环境中有效。
层面三:应用与诊断方法创新
治疗用途的重新定义:
专利不仅涵盖了用抗体抑制ST2通路来治疗炎症(如哮喘、COPD)的传统思路,还首次提出了通过抑制IL-33-DSB/RAGE相互作用来调节组织修复过程,或通过催化性抗体来“模拟生理失活”的治疗新范式。
新型检测方法:
基于对两种形式的区分,专利要求保护特异性检测样品中redIL-33(活性形式)的方法。这解决了现有检测技术的盲点,能够更准确地评估疾病的活性状态和治疗靶点的负荷,对于精准医疗和伴随诊断具有重要意义。
PROTAC与小分子:挑战与潜在机遇
与专利中突出的抗体策略相比,小分子和PROTAC在靶向IL-33方面面临着独特的挑战和机遇。
小分子抑制剂
挑战:IL-33与ST2的相互作用是一个典型的、面积较大的蛋白质-蛋白质相互作用界面。这类界面通常缺乏适合小分子结合的“深口袋”,使得开发高亲和力、高特异性的口服小分子抑制剂变得极其困难。目前,该领域鲜有成功的报道。
潜在路径:如果发现ST2或IL-33上存在可用于小分子结合的特定位点,或通过别构调节机制来间接破坏其结合,小分子药物仍是一个有吸引力的方向,尤其在口服给药方面具有优势。
PROTAC策略
挑战:PROTAC技术旨在诱导细胞内靶蛋白的降解。然而,IL-33是一个分泌型细胞因子,其主要在细胞外空间发挥作用。传统的PROTAC需要进入细胞才能招募E3泛素连接酶,因此对细胞外蛋白无效。这是针对IL-33本身的主要障碍。
创新机遇:
靶向受体降解:一个更可行的PROTAC策略是靶向降解IL-33的受体ST2。通过设计一个同时结合ST2和E3连接酶的双功能分子,可以诱导细胞膜上ST2的内化和降解,从而从根源上降低细胞对IL-33的敏感性。
靶向胞内前体:虽然成熟IL-33被分泌,但其前体在核内合成。理论上,可以设计靶向IL-33前体的PROTAC,在其被释放前就将其降解。但这需要精确区分前体与其他核蛋白,且可能干扰其未知的核内功能,策略更为复杂。
优爱生物IL-33全长蛋白:解锁活性构象,赋能创新药物发现
优爱生物(UA)推出的重组人IL-33全长蛋白,并非一款普通的细胞因子试剂,而是专为基于结构的药物发现(SBDD)和功能筛选所设计的关键工具。尤其在针对IL-33这一极具挑战性靶点的创新疗法(如中和抗体、受体拮抗剂)研发中,本产品凭借其卓越的构象真实性与功能性,成为研究人员不可或缺的利器。
精准模拟天然活性构象,攻克研发首要难题
传统IL-33蛋白制剂中,活性还原形式(redIL-33)与无活性氧化形式(IL-33-DSB)共存且动态转化,为筛选带来了巨大干扰。优爱生物的IL-33全长蛋白,通过专利性的生产工艺与质控体系,确保了产品能够最大程度地维持或模拟其天然的、具有生物活性的还原形式(redIL-33)。这使得研究人员能够直接以最相关的生理靶点结构进行:
高特异性抗体筛选:作为免疫原,可诱导产生直接靶向redIL-33表位的抗体,而非与氧化形式交叉反应的抗体,从源头提升候选药物的有效性与特异性。
表位作图与竞争性结合分析:精准鉴定抗体或小分子与活性IL-33的结合位点,区分其作用机制为直接阻断ST2结合还是别构调节。
经多层次验证的功能活性,确保数据可靠性!
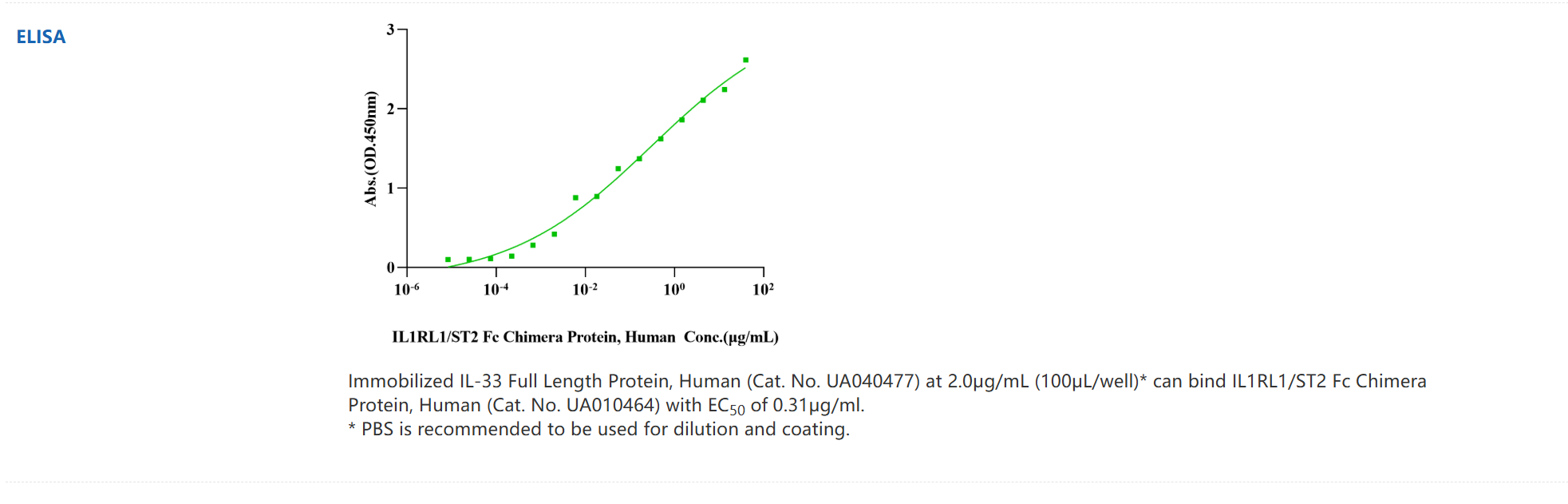
IL-33 Full Length Protein, Human_UA040477_优爱(UA BIOSCIENCE)官网












