- 最新进展
- 产品信息
问:正常情况下,免疫细胞中的巨噬细胞是如何对抗癌细胞的?
巨噬细胞作为人体先天免疫系统的重要组成部分,具有识别、吞噬并消灭异常细胞(包括癌细胞)的能力。在健康机体中,它们通过表面受体检测到癌细胞的“异常信号”,进而发起攻击。这一过程类似于身体内部的“巡逻兵”,随时清除可能威胁健康的目标。然而,癌细胞并非被动挨打,它们演化出了多种机制来逃避巨噬细胞的监视,其中最为关键的策略之一是释放“别吃我”信号。
问:什么是CD47?它在癌细胞免疫逃逸中扮演什么角色?
CD47是一种广泛表达于正常细胞表面的蛋白质,其通过与巨噬细胞表面的受体SIRPα结合,传递“别吃我”信号,从而避免健康细胞被误噬。然而,癌细胞狡猾地利用了这一机制:它们通过过表达CD47蛋白,伪装成正常细胞,使巨噬细胞无法识别其危险性。这一发现由斯坦福大学医学院的Irving L. Weissman团队等率先揭示,并推动了针对CD47的抗体药物研发。例如,临床试验显示,CD47抗体Hu5F9-G4联合利妥昔单抗对某些淋巴瘤患者具有显著疗效。
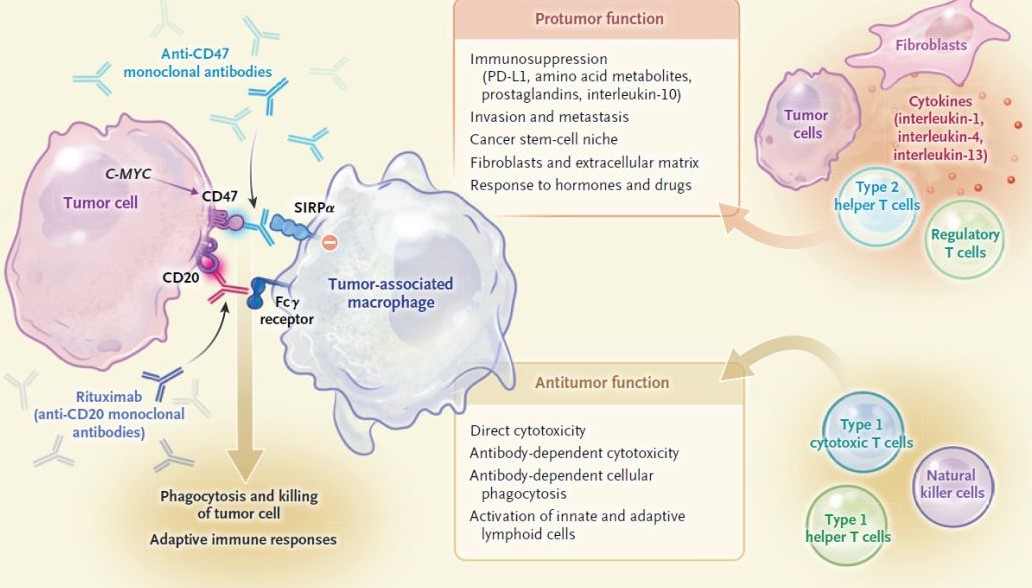
问:为什么仅仅阻断CD47有时并不能有效恢复巨噬细胞的抗癌功能?
尽管CD47抗体在部分癌症类型中表现出潜力,但临床研究显示,并非所有患者都对这类药物产生响应。Weissman教授指出,这表明癌细胞可能还存在其他未知的“别吃我”信号机制。如果癌细胞能在巨噬细胞密集的肿瘤微环境中持续生长,它们很可能通过多种分子途径抑制免疫攻击。这种冗余机制促使科学家继续寻找新的免疫检查点分子。
问:CD24是如何被发现的?它在癌细胞中有什么作用?
在2020年7月发表于《自然》杂志的一项研究中,Weissman团队首次证实CD24是另一种重要的“别吃我”信号蛋白。CD24(分化簇24)是一种高度糖基化的膜蛋白,此前已知它在炎症调节中通过与免疫细胞表面的Siglec-10受体相互作用抑制过度免疫反应。然而,该研究发现,在多种实体肿瘤(如卵巢癌和三阴性乳腺癌)中,CD24显著过表达,并且与肿瘤相关巨噬细胞上的Siglec-10结合,直接抑制巨噬细胞的吞噬功能。
问:CD24与CD47在作用机制上有何异同?
CD24和CD47均属于“别吃我”信号蛋白,但它们在癌症类型中的作用似乎具有互补性。例如,血液肿瘤(如白血病)对CD47阻断更敏感,而某些实体瘤(如卵巢癌)则高度依赖CD24信号。实验表明,在培养皿中将人类癌细胞与巨噬细胞共培养后,若使用抗体阻断CD24与Siglec-10的相互作用,巨噬细胞会迅速吞噬癌细胞。同样,在移植人类乳腺癌细胞的小鼠模型中,阻断CD24信号可显著抑制肿瘤生长并延长生存期。
问:针对CD24的疗法有哪些临床前景?
CD24-Siglec-10通路的发现为癌症免疫治疗提供了新靶点。尤其对于卵巢癌和三阴性乳腺癌这类目前治疗手段有限、预后较差的癌症类型,CD24抑制剂可能成为突破方向。Weissman教授表示,这类药物有望遵循与CD47抗体相似的开发路径:首先在临床前研究中验证安全性,进而推进至人体临床试验。需要注意的是,CD24在正常组织中也具有一定功能,因此药物设计需精确靶向肿瘤微环境,以避免潜在副作用。
问:这一发现对癌症免疫治疗的未来意味着什么?
CD24的揭示不仅拓宽了人们对肿瘤免疫逃逸机制的认知,也强调了对不同癌症类型需采取个体化治疗策略。联合靶向多个“别吃我”信号(如CD47和CD24)或许能更全面地激活巨噬细胞功能,改善患者响应率。此外,该研究也提醒科学界,先天免疫系统中可能还存在更多未知的免疫检查点,值得进一步探索。
总结
从CD47到CD24,科学家们逐步揭开了癌细胞如何通过“别吃我”信号逃避免疫攻击的面纱。这些发现不仅深化了对肿瘤微环境的理解,也为开发新一代免疫疗法提供了方向。随着研究的推进,未来患者有望迎来更多针对高危癌症的有效治疗选择。












