- 最新进展
- 产品信息
问:CEACAM5是什么?它在癌症研究中为何受到关注?
CEACAM5,通常被称为癌胚抗原(Carcinoembryonic Antigen, CEA),也被命名为CD66e,是一种广泛研究的肿瘤相关抗原。它属于CEACAM(癌胚抗原相关细胞粘附分子)家族,是通过糖基磷脂酰肌醇(GPI)锚定在细胞膜表面的糖蛋白。因其在多种恶性肿瘤中高度表达,而在正常成人组织中表达水平较低,CEA长期被视为一种重要的肿瘤生物标志物,尤其在结直肠癌诊断与疗效监测中广泛应用。近年来,随着免疫治疗的发展,CEA也逐渐成为CAR-T细胞疗法和抗体类药物研究的热点靶点。
问:CEACAM家族包括哪些成员?它们有何共同特点?
CEACAM家族包含12个已知成员(如CEACAM1、3-8、16、18-21),这些蛋白在结构上多数具有免疫球蛋白样结构域,广泛表达于多种正常组织与肿瘤组织中,不仅参与细胞间的识别与粘附,也在炎症反应、血管生成及肿瘤进展与转移中发挥重要作用。其中,CEACAM1、5、6和7的研究较为深入,它们尤其在肿瘤发生和发展过程中显示出重要的生物学和临床意义。
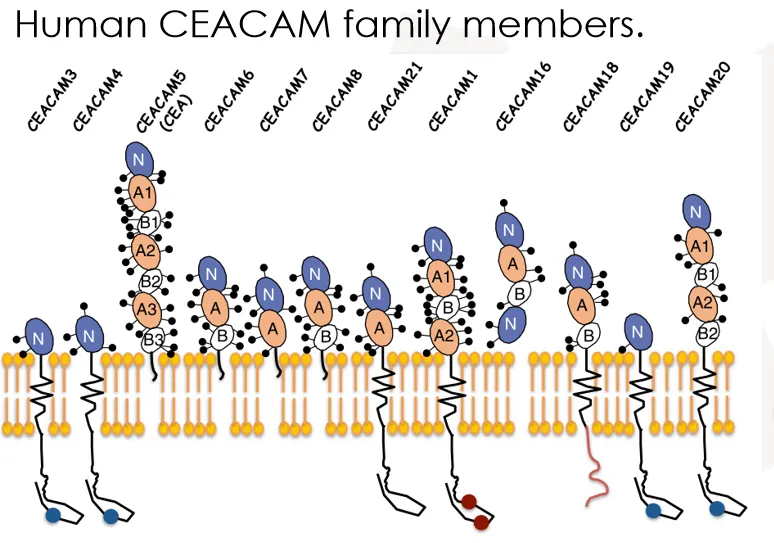
问:CEA的分子结构有何特征?
CEA的蛋白结构复杂而精巧。其氨基端(N端)包含一个免疫球蛋白可变样结构域(IgV),之后是三个结构类似的重叠单元,共包括六个免疫球蛋白恒定样结构域(IgC2),分别命名为A1、B1、A2、B2、A3、B3。值得注意的是,CEA通过GPI锚点附着于细胞膜,这意味着它本身不具备跨膜区,这一特征可能影响其信号转导机制及治疗抗体的设计策略。
问:CEA在正常人体内如何表达?
在正常成人组织中,CEA的表达水平较低且具有一定组织特异性。它主要存在于结肠、胃、舌、食管等黏膜上皮细胞表面,也可在乳腺、汗腺等组织中检测到微量表达。值得注意的是,CEA在胚胎发育期间表达较高,出生后则显著下降,“癌胚抗原”的名称正源于其在胚胎期与某些癌症中的重新高表达现象。
问:哪些肿瘤会高表达CEA?其临床意义是什么?
CEA在多种上皮源性肿瘤中呈现过表达,尤其在结直肠癌、胃癌、胰腺癌、非小细胞肺癌及乳腺癌中较为常见。因其在血清中的水平与肿瘤负荷、进展及预后密切相关,CEA检测被广泛用于结直肠癌的筛查、疗效评估及复发监测。值得注意的是,尽管CEA是一种广谱肿瘤标志物,其水平升高也可见于某些良性疾病(如炎症、肝硬化等),因此在临床解读时需结合影像学与病理学等其他信息综合判断。
问:以CEA为靶点的CAR-T细胞疗法目前进展如何?
近年来,CEA已成为实体瘤CAR-T疗法的重要研究方向。例如,中南大学湘雅医院团队曾报道成功应用靶向CEA的第三代CAR-T细胞治疗晚期肺癌患者,展示了初步的安全性与抗肿瘤效果。目前,全球多项针对CEA阳性实体瘤(如结直肠癌、胃癌、胰腺癌)的CAR-T临床研究正处于I/II期试验阶段。尽管病例数尚有限,且面临肿瘤微环境抑制、靶向非肿瘤毒性等挑战,这些早期探索为CEA导向的细胞治疗提供了有价值的临床依据。
问:除了CEA,还有哪些类似的实体瘤靶点?
间皮素(Mesothelin, MSLN)是另一个备受关注的广谱实体瘤靶点,其在恶性间皮瘤、胰腺癌、卵巢癌、肺腺癌等多种肿瘤中高表达,而在正常组织分布局限。例如,CAR-T先驱Carl June教授团队曾开展靶向间皮素的CAR-T治疗晚期胰腺癌的临床研究,部分患者显示疾病稳定甚至转移灶代谢活性显著下降。与CEA类似,MSLN因其在肿瘤中的特异性表达模式,成为抗体药物偶联物(ADC)、CAR-T及双特异性抗体等创新疗法开发的理想靶标。
问:CEA靶向治疗的未来发展方向是什么?
CEA作为一个研究历史悠久的肿瘤标志物,正焕发出新的研发活力。未来的研究将更聚焦于提高治疗安全性(如通过逻辑门控CAR设计减少对正常组织的脱靶效应)、克服肿瘤异质性和免疫抑制微环境,以及探索CEA抗体药物偶联物(ADC)、双特异性T细胞衔接器(BiTE)等多元化的治疗模式。随着更多临床数据的积累和治疗策略的优化,CEA有望成为突破实体瘤免疫治疗瓶颈的关键靶点之一。












