- 最新进展
- 产品信息
- 参考文献
在消化道肿瘤治疗领域,一个名为CDH17(钙黏蛋白17,又称肝肠钙黏蛋白)的靶点正以惊人的速度崛起,成为全球药企竞相布局的“黄金赛道”。从双特异性抗体到抗体偶联药物(ADC),再到CAR-T细胞疗法,CDH17靶点的药物研发呈现多技术路线并行、临床进展密集的态势。近期翰森制药与罗氏达成重磅合作,高达15.3亿美元的授权交易,更将这一靶点推向了全球生物医药产业的聚光灯下。
CDH17:消化道肿瘤的“精准靶标”
CDH17属于钙黏蛋白超家族的非经典成员,其结构独特:由七个细胞外钙黏蛋白重复序列和一个极短的细胞质结构域构成。在正常组织中,CDH17的表达高度局限于肠上皮基底外侧膜,而在胃癌、结直肠癌、胰腺癌、肝癌等消化道恶性肿瘤中却显著过表达。研究表明,超过90%的结直肠癌、50%的胃癌及胰腺癌患者存在CDH17异常表达,且其表达水平与肿瘤侵袭、转移及不良预后密切相关。
这种“肿瘤特异性表达”特性使CDH17成为理想的药物靶点:既能精准攻击肿瘤细胞,又能最大限度减少对正常组织的损伤。临床前研究显示,CDH17通过激活Wnt/β-catenin信号通路、调控细胞黏附与增殖、促进肝转移等机制驱动肿瘤进展,为靶向治疗提供了多重作用路径。
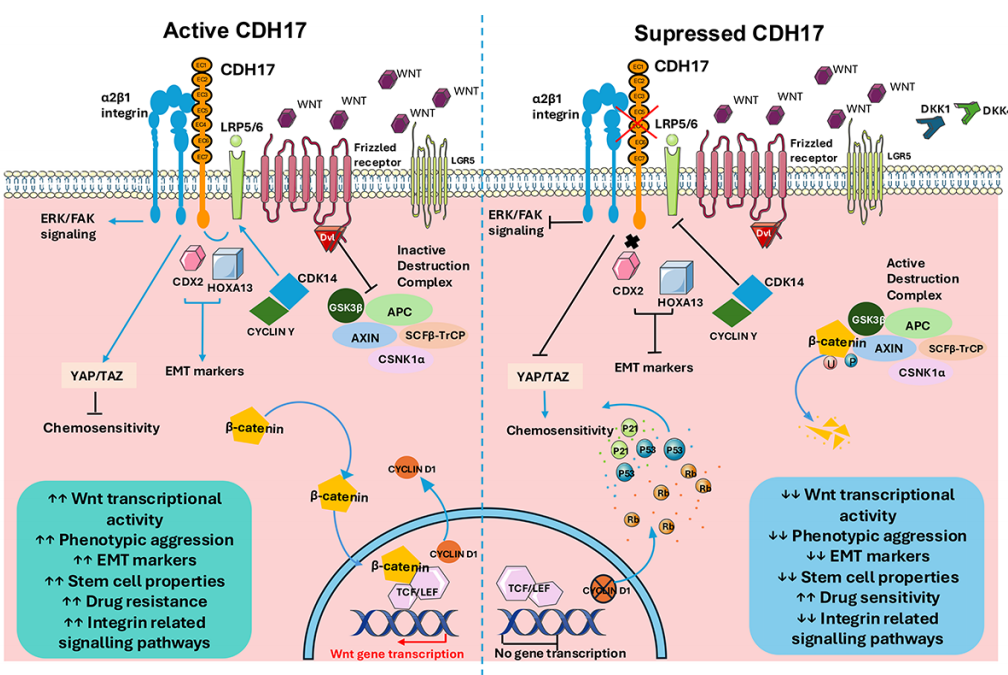
Wnt/β-catenin通路与CDH17介导的肿瘤生物学调控示意图
技术路线争锋:双抗、ADC、CAR-T三箭齐发
1、双特异性抗体:T细胞重定向的“精准制导”
ARB202是全球首款进入临床的CDH17xCD3双抗,采用TriAx技术构建,通过同时结合肿瘤细胞表面的CDH17和T细胞表面的CD3,激活T细胞杀伤肿瘤。其独特设计避免了过度激活T细胞导致的全身免疫反应,在澳洲I期试验中展现出良好的安全性,10例受试者中未观察到剂量限制性毒性(DLT)。另一款双抗BI905711则通过交联CDH17与死亡受体TRAILR2,诱导肿瘤细胞凋亡,在Ia/Ib期研究中使13例晚期胃肠道癌症患者病情稳定。
2、ADC:毒素递送的“智能炸弹”
ADC是CDH17靶点研发最活跃的领域。翰森制药的HS-20110采用拓扑异构酶I抑制剂SHR-9265作为载荷,通过优化可裂解连接子实现肿瘤微环境特异性释放,在结直肠癌PDX模型中抑制率超90%,且能穿透肝转移基质屏障。迈威生物的7MW4911则基于IDDC™平台,搭载专有毒素MF-6,在多药耐药模型中疗效显著优于传统ADC,食蟹猴毒理研究显示治疗窗口超20 mg/kg。宜联生物的YL217通过TMALIN®平台实现连接子肿瘤特异性裂解,在胃癌模型中达成100%完全缓解。
3、CAR-T:实体瘤突破的“终极武器”
宾夕法尼亚大学开发的CHM-2101是全球首款进入临床的CDH17 CAR-T,采用第三代设计(CD28+4-1BB共刺激结构域),在7种癌症模型中实现肿瘤完全根除。其核心机制在于:正常细胞中CDH17隐藏于紧密连接下,而肿瘤细胞表面CDH17暴露,使CAR-T可特异性识别并杀伤肿瘤。目前该疗法已获FDA批准开展结直肠癌、胃癌和神经内分泌肿瘤的I/II期试验。
资本狂欢:15.3亿美元交易背后的产业逻辑
2025年10月17日,翰森制药与罗氏达成重磅合作:将HS-20110在大中华区以外的全球权益授予罗氏,首付款8000万美元,里程碑付款最高14.5亿美元,交易总额达15.3亿美元。这一数字不仅刷新了中国ADC出海纪录,更揭示了CDH17靶点的巨大商业价值。
交易逻辑解析:
临床需求缺口:结直肠癌是全球第三大癌症,中国年新发56.9万例,晚期患者五年生存率不足15%。现有疗法(如化疗、EGFR抑制剂、PD-1抑制剂)对转移性患者效果有限,亟需新机制药物。
靶点差异化优势:CDH17在MSS型(微卫星稳定型)结直肠癌中高表达,而PD-1抑制剂对该类型患者无效(占比85%)。HS-20110的临床前数据显示其可覆盖MSS难治群体,与化疗或免疫疗法联用潜力巨大。
中国企业技术崛起:全球进入临床阶段的9款CDH17 ADC均来自中国药企,涵盖普众发现、翰森制药、康诺亚等。中国企业在靶点选择、分子设计(如定点偶联技术)和临床推进速度上已形成全球领先优势。
未来展望:从“跟跑”到“领跑”的产业跃迁
CDH17靶点的爆发并非偶然。中国药企通过前瞻性布局新兴靶点、构建全产业链研发体系、利用患者资源优势加速临床,已从“仿制”转向“创新”。罗氏、GSK等跨国药企重金押注中国管线,既是对CDH17潜力的认可,也是对中国生物医药产业升级的投票。
随着双抗ADC、双载荷ADC等新技术的涌现,CDH17有望成为首个突破实体瘤治疗瓶颈的靶点。正如罗氏全球药品开发首席医学官所言:“CDH17 ADC代表了一种全新治疗范式,它可能改写晚期消化道癌症的生存曲线。”在这场全球竞赛中,中国药企正以创新为刃,劈开一条通往国际舞台的黄金大道。
优爱CDH17靶点蛋白 部分数据分享:
CDH17/LI-cadherin His Tag Protein, Human 货号:UA010825

Immobilized CDH17/LI-cadherin His Tag, Human (Cat. No. UA010825) at 2.0μg/mL (100μL/well) can bind Cadherin 17 Recombinant Rabbit mAb (SDT-736-23) (Cat. No. S0B2291) with EC50 of 1.25-1.75ng/mL.
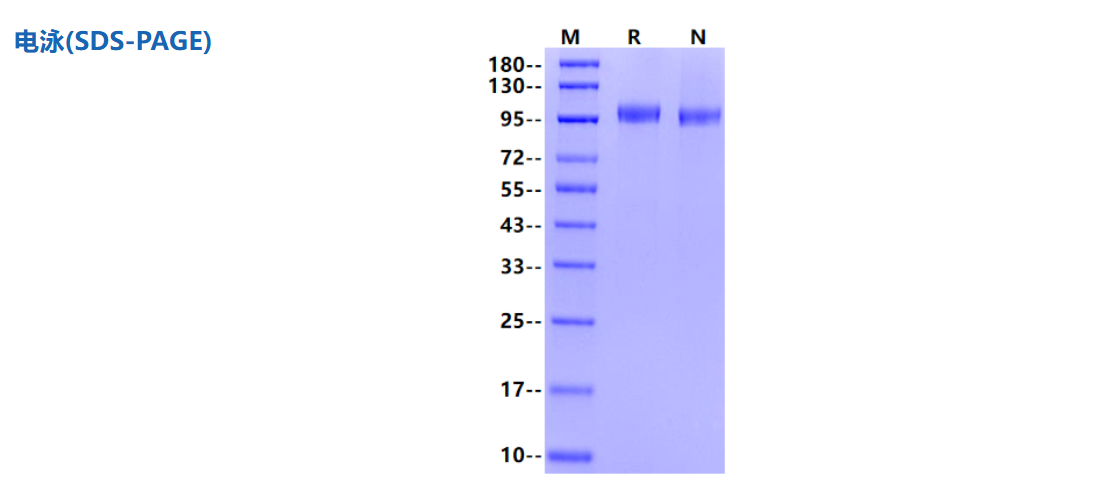
1μg (R: reducing condition, N: non-reducing condition).
CDH17/LI-cadherin His Tag Protein, Human_UA010825_优爱(UA BIOSCIENCE)官网
Bandana Shrestha; Yanping Feng; A. Lad; Anthony S. Bates; Jing Chen; et al. The Role of Cadherin 17 (CDH17) in Cancer Progression via Wnt/β-Catenin Signalling Pathway: A Systematic Review and Meta-Analysis. International Journal of Molecular Sciences.2025-10-10.












