- 最新进展
- 产品信息
什么是MUC-1?它在人体中有哪些别名和基本功能?
MUC-1,也称为粘蛋白-1,是一种广泛表达于上皮细胞和造血细胞表面的跨膜糖蛋白。该蛋白拥有众多别名,包括Breast carcinoma-associated antigen DF3、Cancer antigen 15-3 (CA15-3)、CD227、Episialin等,这些名称反映了其在多种研究和临床背景中的应用。MUC-1具有类似受体的结构,能够感知细胞外环境变化,并通过其胞质结构域激活下游信号通路。其胞外段可在特定条件下被释放,既可作为黏膜病原体的分子“诱饵”,也可作为某些呼吸系统疾病(如肺癌和间质性肺病)的诊断和预后血清标志物。此外,在激活状态下,MUC-1的胞质尾部(MUC1-CT)能够调节炎症反应,并在多种慢性气道疾病中发挥抗炎作用。
MUC-1的分子结构有哪些关键特征?
MUC-1蛋白包含一个N端亚单位(又称KL-6),由信号肽、可变数目串联重复序列(VNTR)和SEA结构域组成。其C端亚单位则包括胞外区、跨膜区及胞质尾部(CT)。该蛋白的胞外段可通过自蛋白水解或金属蛋白酶介导的切割进入细胞外腔隙。MUC1-C在Asn-36位点发生糖基化,这一修饰影响其与半乳糖凝集素-3等分子的结合能力。胞质尾部含有多个潜在磷酸化位点,可响应生长因子及激酶信号。CQC基序促进MUC1-C寡聚化,RRK基序则协助其通过importin β进入细胞核。此外,该区域还包含β-连环蛋白(β-catenin)的结合位点。MUC1基因位于1号染色体,通过可变剪接产生超过70种异构体,进一步扩展了其功能多样性。
MUC-1在正常组织和肿瘤组织中的表达有何不同?
在正常人体组织中,MUC-1呈极性分布,高表达于鼻咽、支气管、肺、胃和皮肤等上皮细胞的腔面,起到润滑、保湿及物理屏障的作用。而在多种恶性肿瘤——如乳腺癌、膀胱癌、胰腺癌和卵巢癌中,MUC-1呈现过度表达和糖基化异常。其细胞分布失去极性,遍布整个细胞表面,从而参与肿瘤的发生、侵袭和转移。这种表达模式和结构的改变使其成为多种癌症预后判断和治疗的重要靶点。
MUC-1在肺癌进展中通过哪些机制发挥作用?
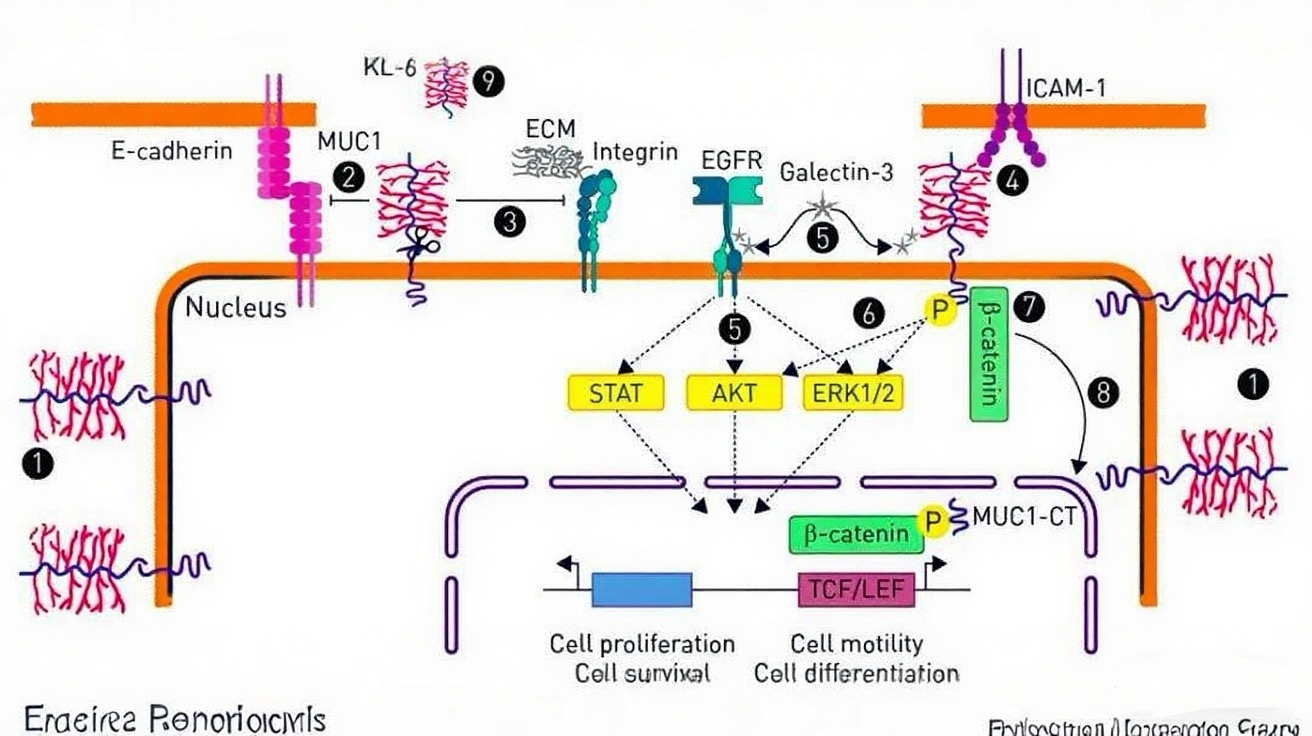
在肺癌中,MUC-1通过多种途径促进肿瘤恶性进展:
其过表达与去极化增强了与多种信号分子的相互作用,从而提高肿瘤细胞的侵袭与转移能力;
通过干扰E-钙黏蛋白破坏细胞间连接,降低细胞粘附性;
抑制整合素介导的细胞-基质粘附;
与ICAM-1等粘附分子结合,促进肿瘤细胞与内皮的相互作用;
MUC1-C与半乳糖凝集素-3结合后可增强EGFR信号激活,进而促进细胞增殖与存活;
激活MAPK和PI3K/AKT信号通路,协同增强细胞运动与生长;
磷酸化后的MUC1-CT与β-连环蛋白结合,进入细胞核调控增殖与分化相关基因;
其脱落片段KL-6可作为血清标志物,用于肺癌预后评估及治疗反应监测。
MUC-1在气道炎症及慢性肺部疾病中扮演什么角色?
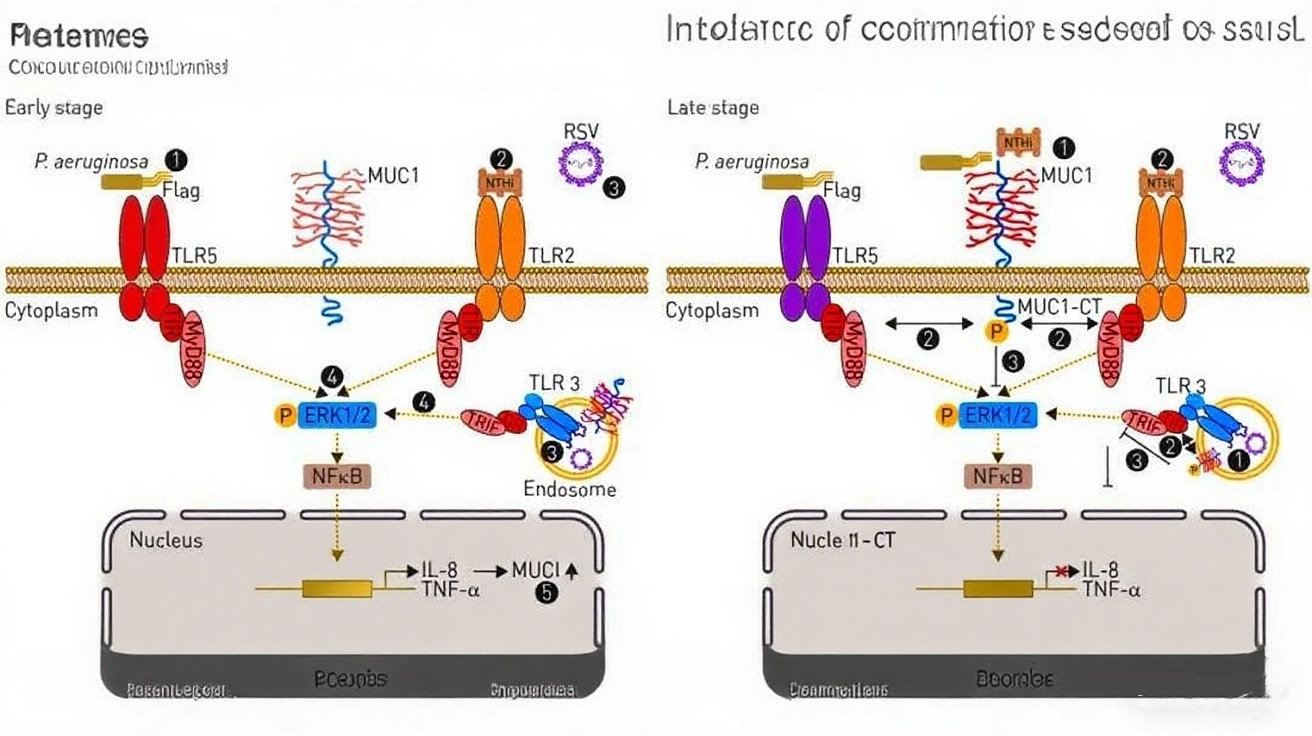
在气道感染和炎症过程中,MUC1-CT可与Toll样受体(如TLR5)形成复合物,调节天然免疫应答。在慢性鼻窦炎(CRS)、重度哮喘和慢性阻塞性肺疾病(COPD)中,MUC1参与皮质类固醇介导的抗炎反应,通过促进抗炎基因表达减轻炎症损伤。这些功能突显了其在呼吸系统疾病中的双向调节作用,既可能助长肿瘤发展,又可能在炎症环境中发挥保护性作用。
MUC-1靶向治疗的临床开发取得了哪些进展?
截至2023年,全球已有至少19种针对MUC-1的候选药物进入临床试验阶段,涵盖单克隆抗体、抗体药物偶联物(ADC)、放射偶联药物、CAR-T细胞疗法和治疗性疫苗等多种类型。目前,多项CAR-T靶向治疗试验正在积极招募患者,适用于肺癌、乳腺癌、肝内胆管癌等恶性实体瘤。这些策略试图利用MUC-在肿瘤细胞中的高表达和特殊糖基化状态,实现精准打击,从而改善治疗反应和患者生存率。
总结:MUC-1在生理与病理过程中的双重角色是什么?
MUC-1作为一种多功能分子,既在上皮细胞的正常生理活动中发挥保护作用,又在多种疾病尤其是癌症中充当关键推动因子。其结构功能特性——包括异常糖基化、磷酸化与蛋白切割——深刻影响细胞内信号转导和基因表达。从呼吸系统炎症到恶性肿瘤的发生与发展,MUC-1均参与调控,使其成为重要的诊断标志和治疗靶点。未来随着MUC1靶向治疗策略的不断成熟,尤其是基于其分子特征的免疫疗法和联合用药方案,有望为肺癌、乳腺癌等多种高发肿瘤提供新的治疗选择。












