- 最新进展
- 产品信息
低密度脂蛋白(LDL)是什么,为何与心脏病密切相关?
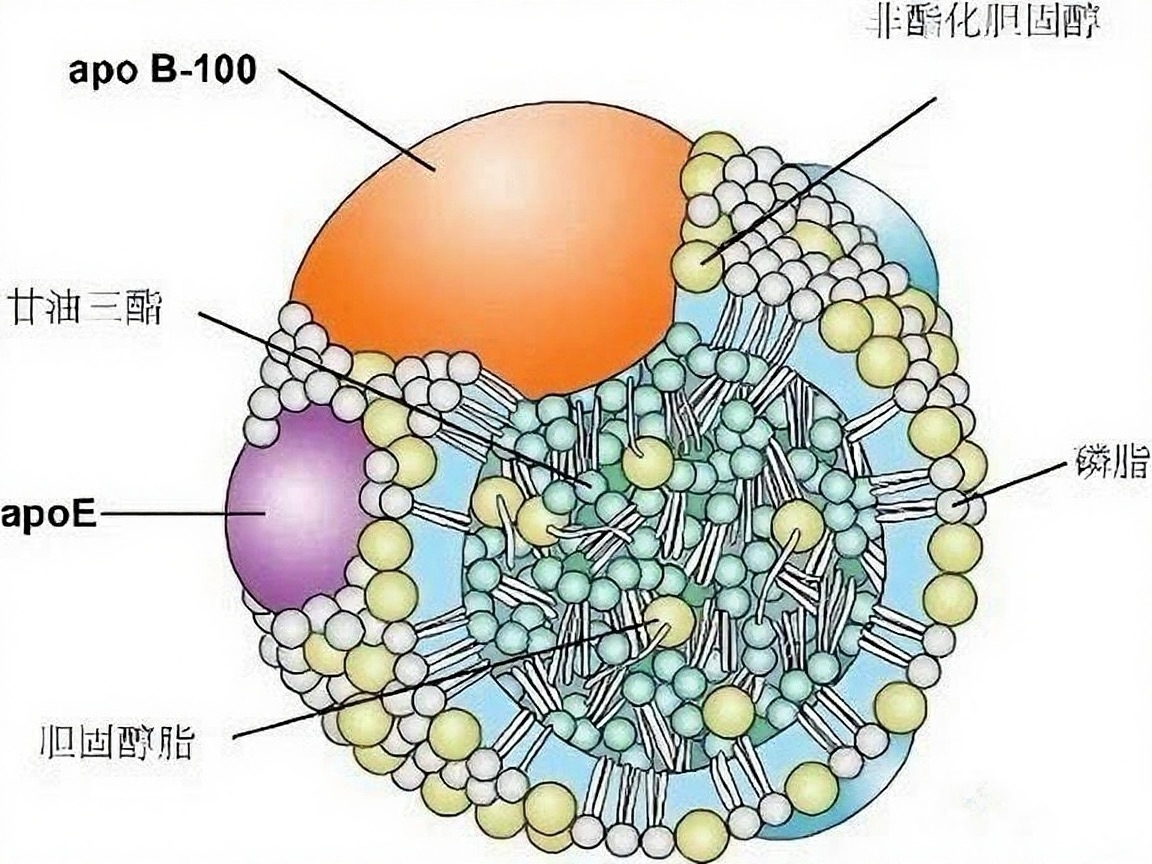
低密度脂蛋白(LDL)是血浆中一类密度较低的脂蛋白颗粒,其主要功能是在血液中运输胆固醇。在健康人体内,约三分之二的血浆胆固醇与LDL结合,形成所谓的低密度脂蛋白胆固醇(LDL-C)。尽管胆固醇是细胞膜结构和类固醇激素合成的重要原料,但过高水平的LDL-C却成为心血管健康的“隐形杀手”。
当LDL颗粒在血液中过量存在时,易渗透至血管内皮下层并发生氧化修饰。巨噬细胞作为免疫系统的重要成员,会吞噬这些氧化的LDL颗粒。然而,这一过程却导致巨噬细胞转化为充满脂质的“泡沫细胞”,沉积于动脉血管壁内。随着胆固醇酯不断堆积,血管壁逐渐形成粥样硬化斑块,使血管管腔狭窄、血流受阻,最终显著增加心肌梗死和脑卒中的发病风险。
谁是揭开LDL代谢奥秘的关键科学家?
人血浆中LDL-C的正常范围通常界定为0–3.37 mmol/L,其中约65%–70%的清除工作依赖于肝脏表面的一种特定受体——低密度脂蛋白受体(LDLR)。这一重要受体的发现并非偶然,而是源于一段跨越国界的科研合作与不懈探索。
1972年,美国德克萨斯大学西南医学中心的Michael Brown和Joseph Goldstein教授开始对家族性高胆固醇血症(FH)展开研究。FH是一种常染色体显性遗传病,患者血液中胆固醇水平异常升高,早年即发生严重动脉粥样硬化。然而当时胆固醇调控的机制仍属未知。两位科学家从日本神户大学渡边雄(Yutaka Watanabe)教授提供的WHHL家兔(一种自发性高胆固醇血症模型)中获得重要线索,最终成功识别出LDLR,并证实其基因缺陷是FH的主要致病原因。
这一重大发现不仅揭示了胆固醇代谢的核心调控机制,也为后续脂代谢疾病的研究奠定坚实基础。鉴于其卓越贡献,Brown和Goldstein于1985年共同荣获诺贝尔生理学或医学奖。
LDLR功能受损会导致疾病,那么增强其功能是否成为治疗策略?
既然LDLR功能缺陷可导致高胆固醇血症及心血管疾病,一个自然的科学问题是:能否通过增加LDLR数量或增强其功能以降低血浆胆固醇?这一设想的实现与另一个关键基因——PCSK9的发现密切相关。
2003年,研究人员在一个法国家族中发现了一种与极低血浆胆固醇水平相关的PCSK9基因突变。随后在2005年,美国德克萨斯大学西南医学中心的Helen Hobbs团队报告称,携带PCSK9功能缺失突变的人群虽然LDL-C水平显著降低,但其身体健康状况良好,寿命并未受到影响。这一发现提示,抑制PCSK9可能成为一种安全有效的降胆固醇策略。
进一步机制研究表明,PCSK9蛋白可与肝细胞表面的LDLR结合,促进其内化和降解,从而减少LDLR介导的胆固醇清除。因此,采用单克隆抗体或小分子药物抑制PCSK9,能够显著增加肝细胞膜上LDLR的密度,增强血液中LDL-C的清除能力,为高胆固醇血症的治疗带来革命性突破。
PCSK9抑制剂的问世如何改变心血管疾病治疗格局?
基于上述机制研究的成果,医药界迅速展开了PCSK9抑制剂的研发工作。这类药物通过阻断PCSK9与LDLR的相互作用,减缓LDLR的降解,使肝细胞得以回收和再利用LDLR,从而大幅提升其对血液中LDL颗粒的摄取效率。
临床研究显示,PCSK9抑制剂可显著降低LDL-C水平达50%–60%,甚至在使用最大剂量他汀类药物疗效不佳的患者中仍表现出卓越疗效。此外,大型心血管终点试验证实,PCSK9抑制剂能够进一步降低动脉粥样硬化性心血管疾病(ASCVD)患者的主要不良心血管事件风险。
PCSK9抑制剂的成功研发不仅是转化医学的典范,也标志着人类在对抗高胆固醇血症及相关心血管疾病的道路上迈出了关键一步。从LDLR的发现到PCSK9抑制剂的临床应用,这一段科学之旅彰显了基础研究与临床创新相结合的巨大潜力。












