- 最新进展
- 参考文献
最新进展
一、研究背景
2022 年全球新发癌症病例近 2,000 万,死亡 970 万。传统化疗缺乏靶向性,单抗药物则因细胞毒性不足或耐药而受限。ADC 通过“抗体-连接子-细胞毒载荷”三位一体设计,兼具靶向性与杀伤强度,已成为肿瘤精准治疗的重要支柱。截至 2024 年,全球共批准 15 款 ADC(血液肿瘤 7 款、实体瘤 8 款),另有 400 余款在研,其中 24 项进入 III 期临床。
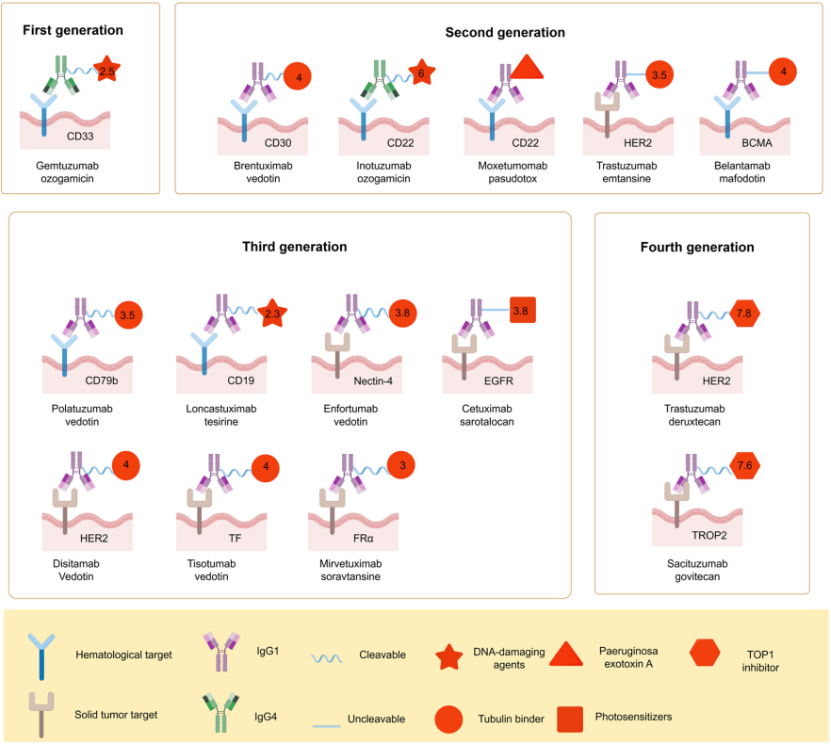
二、ADC 的四代技术演进
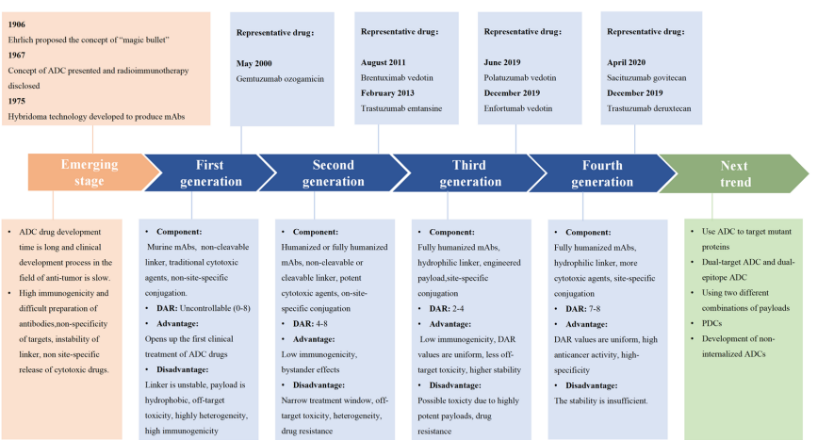
- 第一代(2000 年):鼠源抗体 + 酸敏感腙键 + 卡利奇霉素(如吉妥单抗)。免疫原性高、连接子不稳定,2010 年撤市后 2017 年减量方案重新上市。
- 第二代:人源化/全人源抗体 + 可裂解二肽键(Val-Cit)或不可裂解硫醚键 + 更强载荷(MMAE、DM1)。代表:恩美曲妥珠单抗(T-DM1)。
- 第三代:定点偶联技术(DAR 2–4)、亲水性 PEG 化连接子,降低聚集、延长半衰期。代表:恩福单抗(EV)。
- 第四代:高 DAR(7–8)、跨膜扩散载荷(DXd、SN-38)实现旁观者效应;双抗(双表位/双靶点)ADC 进入临床。代表:曲妥珠-德鲁斯替康(T-DXd)、ZW49、BL-B01D1。
三、核心组成与作用机制
核心组成:
- 抗体:IgG1 占已上市产品 86.7%(13/15),因其 ADCC/CDC 强、半衰期长;IgG4 用于需弱效应功能的场景(如吉妥单抗)。
- 连接子:
- 可裂解 73.3%(11/15),其中酶裂解 Val-Cit / Gly-Gly-Phe-Gly 最常见;
- 不可裂解 26.7%,血浆稳定但无旁观者效应。
- 载荷:
- 微管抑制剂(MMAE/MMAF、DM1/DM4)占已上市 53.3%;
- DNA 损伤剂(卡利奇霉素、PBD)20%;
- TOP1 抑制剂(DXd、SN-38)13.3%,III 期项目占比升至 45.8%;
- 新型载荷:免疫激动剂(TLR7/8、STING)、RNA 聚合酶 II 抑制剂(α-鹅膏蕈素)、光敏剂(IRDye700DX)。
ADC 抗肿瘤作用的不同机制:
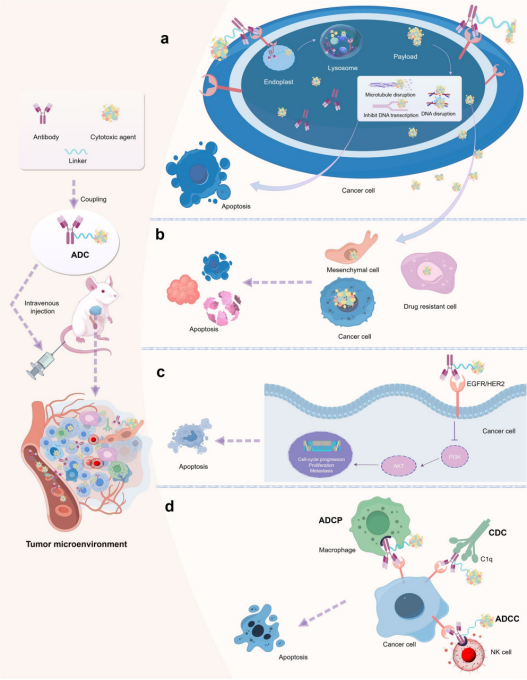
- ADC 的核心机制:ADC 的细胞毒作用通过一系列连续过程实现——与细胞表面抗原结合、ADC-抗原复合物经内吞作用内化、溶酶体降解、细胞毒药物释放至胞质,最终对靶细胞产生细胞毒效应。
- ADC 的旁观者效应:部分药物可能释放到胞外环境,随后被邻近细胞(包括耐药或非靶细胞)摄取。
- ADC 保留 mAb 活性:ADC 中的 mAb 保留其原有功能——干扰靶点功能、抑制下游信号通路并诱导凋亡。
- ADC 的抗肿瘤免疫效应:ADC 的 mAb 可与免疫效应细胞相互作用,触发抗体依赖性细胞介导的细胞毒作用(ADCC)、抗体依赖性细胞吞噬作用(ADCP)和补体依赖性细胞毒作用(CDC)。
四、关键靶点全景
血液瘤:CD33、CD30、CD22、CD79b、BCMA、CD19
实体瘤:HER2(3 款上市 + 8 款 III 期)、TROP2、EGFR、Nectin-4、TF、FRα、CD19。
非内吞靶点(CD20、CAIX、FAP)正在探索,有望突破传统内吞依赖限制。
五、临床转化与代表性数据
- 吉妥单抗:低剂量分次方案使老年 AML 患者 OS 显著延长(AML-19 研究)。
- 维布妥昔单抗:联合 AVD 一线治疗 cHL,2 年 PFS 97.3% vs 92.6%。
- 伊珠单抗:R/R B-ALL CR 率 81%,桥接移植后 1 年 PFS 89%。
- T-DM1:KATHERINE 试验中,术后辅助治疗 3 年无浸润生存 88.3% vs 77%。
- T-DXd:DESTINY-Breast03 中位 PFS 16.4 vs 6.9 个月;DESTINY-Breast04 证实对 HER2-low 人群获益。
- 戈沙妥珠单抗:III 期 ASCENT 研究 mPFS 5.6 vs 1.7 个月,OS 12.1 vs 6.7 个月。
- EV-301/302:既往含铂化疗+免疫经治 mUC,EV+帕博利珠单抗一线 mOS 31.5 vs 16.1 个月。
- 米拉妥珠单抗:SORAYA 研究 FRα 高表达 PROC ORR 32.4%,mDOR 6.9 个月。
- 光免疫疗法 Cetuximab sarotalocan:HNSCC CR 40%,mDOR 9.4 个月,且可激活全身免疫。
六、未来方向
- 双特异/多特异 ADC:同步靶向 HER2×HER3、EGFR×cMet 等,降低逃逸。
- 免疫刺激性 ADC:载荷为 TLR、STING 激动剂,实现“冷”肿瘤免疫微环境重塑。
- 非肿瘤领域:自身免疫、慢性感染、阿尔茨海默病等,需突破血脑屏障递送。
- 个体化策略:基于靶点表达水平、基因突变及药代动力学模型的精准给药。
ADC 经过四代技术革新,已从“概念验证”走向“临床基石”。通过抗体工程、连接子-载荷创新、偶联工艺升级及联合治疗模式,ADC 正不断拓宽肿瘤治疗边界,并向非肿瘤疾病延伸。未来 5–10 年,高 DAR 精准偶联、双特异载荷及免疫协同策略有望将 ADC 推向“泛肿瘤、泛疾病”精准治疗新时代。

ADC全面解决方案:https://www.ua-bio.com/information-detail.html?id=4
参考文献
- Ruili Wang; Baohui Hu; Ziyu Pan; Chen Mo; Xin Zhao; et al. Antibody–Drug Conjugates (ADCs): current and future biopharmaceuticals. Journal of Hematology & Oncology.2025.